GRUPO IVA VA VIA Y VIIA DE LA TABLA PERIÓDICA.
INTRODUCCIÓN
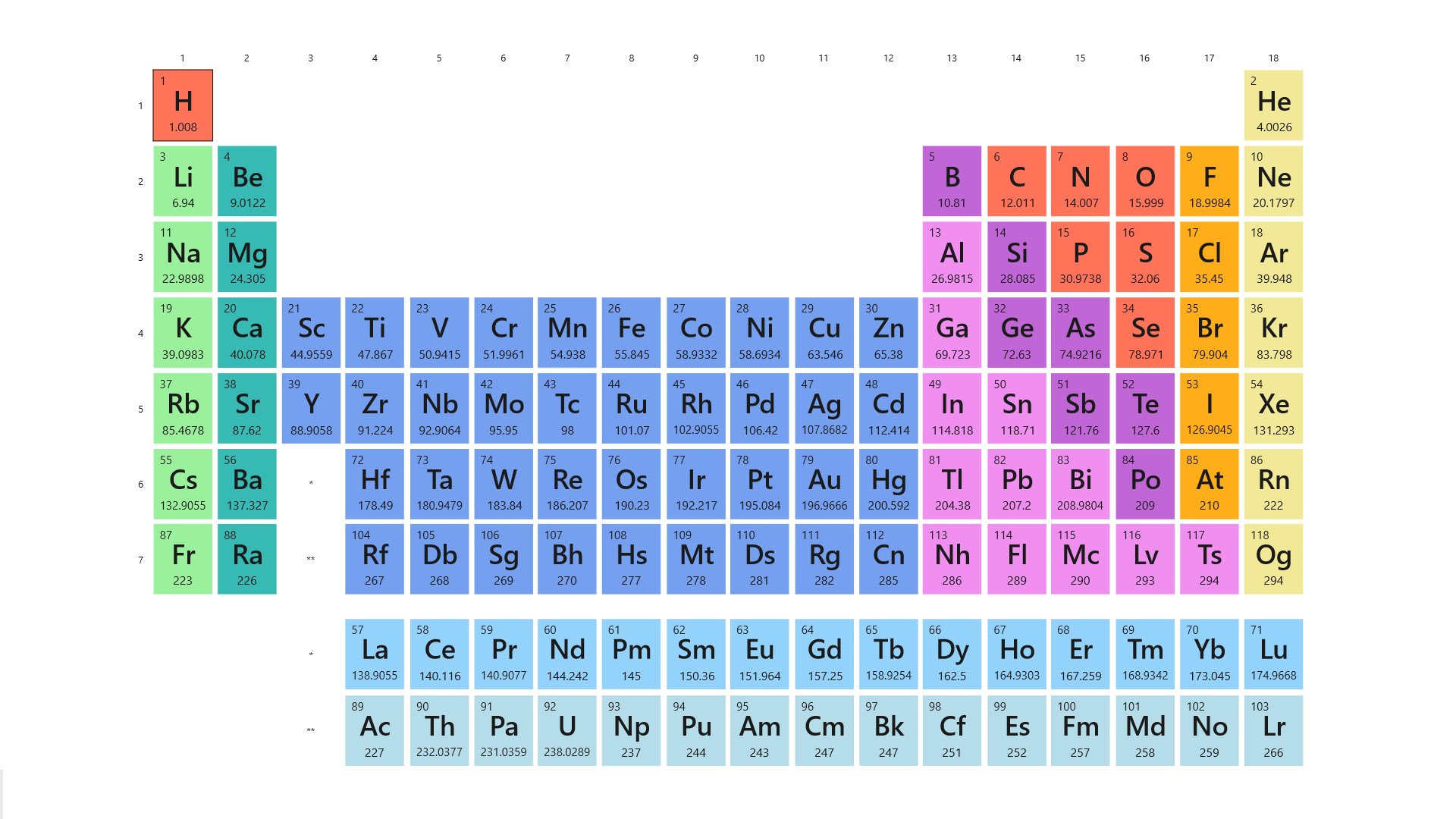
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico, por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna
En el presente blog se darà información sobre 4 de los 18 grupos de la tabla periodica, los cuales son el 4, 5, 6 y 7. Se conoceran las caracteristicas tanto generales como especificas de cada elemento que conforma cada uno de estos grupos (6 elementos por grupo) pertenecientes a los no metales.
OBJETIVOS
- Identificar los elementos pertenecientes a los grupos 4 5 6 y 7 de la tabla periodica.
- Aprender caracteristicas de cada uno de los elementos.
TABLA PERIÓDICA
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas.
Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres.
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha
Se colocan de izquierda a derecha y de arriba a abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.
Hacia abajoy a la izquierda aumenta el radio atómico y el radio iónico. Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegatividad.

GRUPO 4
(GRUPOS DEL CARBONO)
Los elementos del grupo IVA son:
carbono (C)
silicio (si)
germanio (ge)
estaño (Sn)
plomo (Pb)
erristeneo (Eo).
Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2
Los elementos de este grupo presenta diferentes estados de oxidación y estos son
: +2 y +4.
los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico. Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
CARBONO
Elemento químico de número atómico 6, masa atómica 12,01 y símbolo C ; es un no metal sólido que es el componente fundamental de los compuestos orgánicos y tiene la propiedad de enlazarse con otros átomos de carbono y otras sustancias para formar un número casi infinito de compuestos; en la naturaleza se presenta en tres formas: diamante, grafito y carbono amorfo o carbón; en cada una de estas formas tiene muchas aplicaciones industriales.
Caracteristicas
-Simbolo C
-Numero atomico 6
- Material solido y no magnetico
-Masa atomica, 12,0111 u
- densidad 2264 kg/ m3
-El carbono posee formas alotrópicas.
-Su radio atómico le permite forman grandes cadenas.
-El carbono junto al hidrógeno forma compuestos denominados hidrocarburos.
-Es el cuarto elemento mas abundante en masa del universo.

PROPIEDADES
El punto de ebullición del carbono es 3825°C.
La estructura cristalina del carbono es hexagonal, es por este que cuando es sometido a altas temperaturas tiene una forma de diamante.
El carbono tiene una densidad de 2,26 g/cm3; esta tiende a aumentar cuando aumenta el numero atómico
El radio atómico del carbono es de 77 pico metros, el mas pequeño de los elementos pertenecientes a este grupo.
SILICIO
Elemento químico de número atómico 14, masa atómica 28,086 y símbolo Si ; es un no metal sólido, de color amarillento, que se extrae del cuarzo y otros minerales y es el segundo elemento más abundante en la Tierra después del oxígeno; se utiliza en la industria del acero como componente de las aleaciones de silicio y acero, en la fabricación de transistores y circuitos integrados, y sus silicatos, en la fabricación de vidrio, barnices, esmaltes, cemento, porcelana, etc.
Caracteristicas
- Simbolo Si
- Numero atomico 14
- masa atomica 28,085 u
- densidad 2330 kg/ m3
-En su forma cristalina el silicio es duro y poco soluble.
-Es el segundo elemento mas abundante en la corteza terrestre con 27,7 % en peso.
-El silicio cristalino es brillando como un metal y posee un color grisáceo.
-Cuando el silicio se combina con el oxigeno estos forman estructuras poliméricas o discretas.
-El encadenamiento del silicio no es mayor a seis átomos por cadena
-El silicio se encuentra en polvo, policristal y olivino
Caracteristicas
- Simbolo Si
- Numero atomico 14
- masa atomica 28,085 u
- densidad 2330 kg/ m3
-En su forma cristalina el silicio es duro y poco soluble.
-Es el segundo elemento mas abundante en la corteza terrestre con 27,7 % en peso.
-El silicio cristalino es brillando como un metal y posee un color grisáceo.
-Cuando el silicio se combina con el oxigeno estos forman estructuras poliméricas o discretas.
-El encadenamiento del silicio no es mayor a seis átomos por cadena
-El silicio se encuentra en polvo, policristal y olivino

Propiedades
El punto de ebullición del silicio es 3265°C.
El silicio se obtiene calentando dióxido de silicio (SiO2), con un agente reductor como lo puede se el carbono o el magnesio, en un horno eléctrico.
El silicio tiene una densidad de de 2,33 g/cm3 y esta tiende a aumentar cuando aumenta el numero atómico al igual que la del carbono
El radio atómico del silicio es de 118 picometros, el radio del silicio aumenta a medida que aumenta el numero atómico al igual que el de los demás elementos pertenecientes al grupo IV A de la tabla periódica
El punto de fusión del silicio es 1414°C.
GERMANIO
Es un elemento químico con número atómico 32 que pertenece al período 4 de la tabla periódica de los elementos que al igual que el silicio es un metaloide y en su estado puro es sólido y duro, de un color blanco con tonalidades grisáceas. Como semiconductor o metaloide, el germanio presenta cinco isotopos naturales de este elemento: 70 Ge, 72 Ge, 73 Ge, 74 Ge y 76 Ge.
Características
-El germanio conserva su brillo cuando se somete a temperaturas ordinarias
-Resiste a los ácidos y álcalis.
-El germanio tiene una masa atómica de 72,64 u
-Hace parte de un gran número de compuestos organometálicos
-El germanio forma dos hidruros: GeH4 y Ge2H6.

-El punto de ebullición del estaño es 2833°C
-El germanio tiene una densidad de de 5,32 g/cm3.
-El radio atómico del germanio es de 123 picometros, el radio del germanio aumenta a medida que aumenta el numero atómico al igual que el de los demás elementos pertenecientes al grupo IV A de la tabla periódica
-El punto de fusión del germanio es 939°C.
ESTAÑO
El estaño es un metal que tiene como número atómico al 50 y una masa atómica de 72,64. El estaño tiene 9 isotopos estables y otros 18 que no son estables. Es muy maleable a temperatura ambiente, se mezcla con facilidad, y además es resistente a los ácidos y a la intemperie.
CARACTERISTICAS
-Es maleable y que no se oxida fácilmente
-El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico y un semiconductor; el estaño blanco, metálico y conductor eléctrico
-El estaño se encuentra en el mineral de la casiterita
-Se usa como protector del cobre, hierro y entre otros metales gracias a sus capacidades anticorrosivas.

PROPIEDADES :
-El punto de ebullición del estaño es 2602°C
-El estaño tiene una densidad de de 7,26 g/cm3
-El radio atómico del estaño es de 141 picómetros, cumple las mismas características que el de los demás elementos del grupo IV A
-El punto de fusión del silicio es 232°C.
PLOMO
El plomo es un elemento químico de la tabla periódica, su número atómico es 82,este elemento es un metal pesado de color gris-azulado que se funde con facilidad. Resistente a la corrosión y a los ácidos.
CARACTERISTICAS:
-Es un metal toxico
-La mayor producción de este elemento proviene de Malasia, Bolivia e Indonesia
-Su peso atómico es 207,2
-Tiene una gran elasticidad molecular
-Los compuestos de plomo mas utilizados son los óxidos de plomo
-El plomo tiene tan solo cuatro isotopos 204Pb, 206Pb, 207Pb, y 208Pb.

PROPIEDADES:
-El punto de ebullición del silicio es 3265°C
-El plomo tiene una densidad de de 11,3 g/cm3.
-El radio atómico del silicio es de 175 picometros; es el mas grande de grupo IV A
-El punto de fusión del silicio es 328°C.
GRUPO 5
Está formado por los siguientes elementos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el elemento sintético moscovium (Mc). Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
Propiedades físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.
*Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
*El arsénico gris metálico: es la forma más estable de las tres y es un buen conductor del calor pero bastante malo conductor de electricidad.
*El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
*El arsénico negro: Presenta propiedades intermedias entre las formas anteriores.
*De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
*Antimonio puro gris plateado
*Antimonio blanco azulado: es su forma más estable y metálica
*Antimonio negro: Inestable y no metálico
*Antimonio amarillo: Inestable y no metálico
Propiedades químicas:
*Son muy reactivos a altas temperaturas
*No reaccionan con el agua
*No reaccionan con ácidos no oxidantes
*Reaccionan con ácidos oxidantes a excepción del nitrógeno.
*Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
*Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
*El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
NITRÓGENO:
El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones industriales, el gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Entre otros usos del gas nitrógeno tenemos:
*En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
*En la elaboración de acero inoxidable.
*Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves.
*Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza.
*En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo.
*En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico.
Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos. Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados.
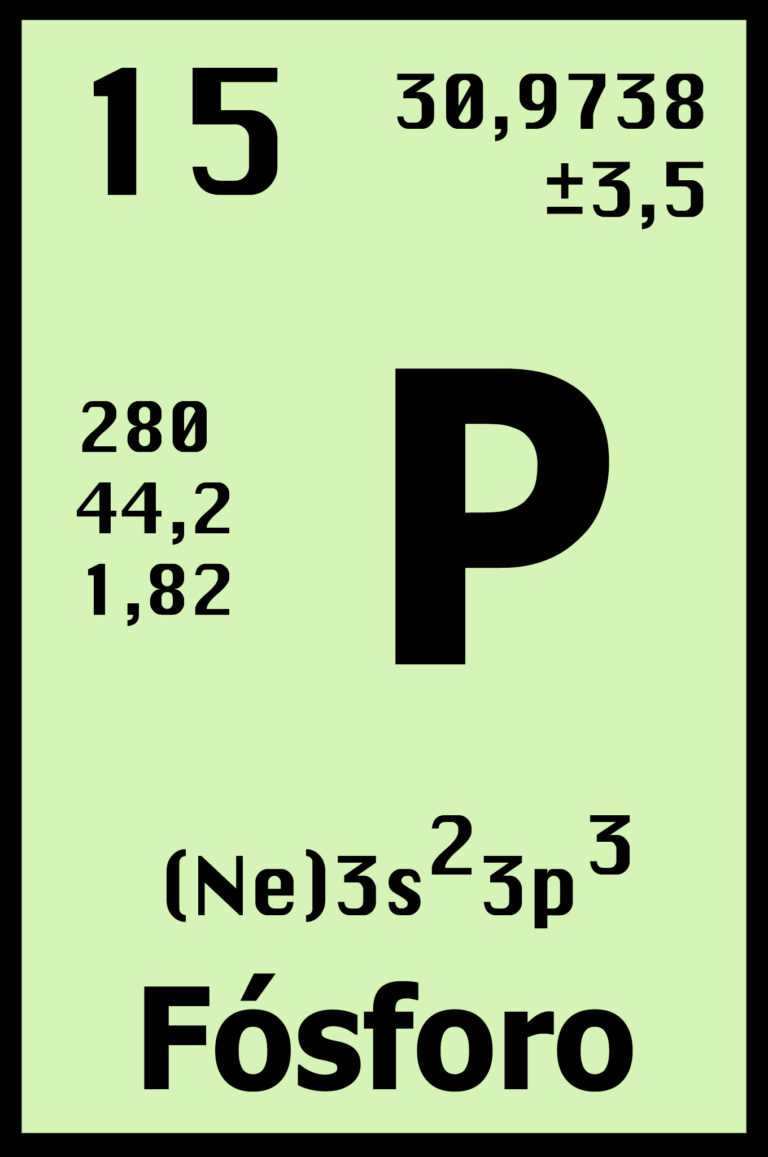
FÓSFORO:
Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
El fósforo en forma de fosfatos esta presente en el ADN
-En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
-Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
-Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
-El tributilfosfato se emplea el proceso purex para extraer uranio.
-El fosfato de calcio es usado para elaborar porcelana fina.
-El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.
ARSÉNICO:
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.
Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos.
Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
*Número atómico: 33
*Masa atómica: 74,92160 u
*Símbolo atómico: As
*Punto de fusión: 817° C
*Punto de ebullición: 603° C
ANTIMONIO:
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.
Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
*El trifluoruro de antimonio se utiliza para la fluoración
*El pentacloruro de antimonio se emplea en la cloración
*El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
*El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
*El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
*El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
*El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos.
*La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica.
El antimonio en su forma elemental es un sólido cristalino, fundible, quebradizo, blanco plateado que presenta una conductividad eléctrica y térmica baja y se evapora a bajas temperaturas. Este elemento semimetálico se parece a los metales en su aspecto y propiedades físicas, pero se comportan químicamente como un no metal. También puede ser atacado por ácidos oxidantes y halógenos.
Las estimaciones sobre la abundancia de antimonio en la corteza terrestre van desde 0,2 a 0,5 ppm. El antimonio es calcófilo, presentándose con azufre y con otros elementos como plomo, cobre y plata.
BISMUTO:
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.
Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.
*Número atómico: 83
*Configuración electrónica: [Xe] 4f14 5d10 6s2 6p3
*MA: 208,98
*Densidad: 9,78g.cm-3
*PF: 271,3 ° C
*PE: 1560 ° C
*Número de protones/electrones: 83
*Número de neutrones: 126
*Clasificación: otros metales
*Color: blanco con tinte rojizo
*Fecha de descubrimiento: conocido por los antiguos
*Descubridor: desconocido
*Nombre de origen: proveniente de la palabra alemana wissmuth (masa blanca)
*Usos: productos farmacéuticos, fusibles
*Obtenido de: hidruro de bismuto
GRUPO 6
Es también llamado como anfígenos, calcógenos o la familia del oxígeno. El término anfígeno procede del griego y significa formador de ácidos y bases. Por su parte, el término calcógeno proviene del griego y significa formador de minerales.
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se muestra en cantidad en estado elemental y combinado formando compuestos. El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores. En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
Propiedades físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta del selenio al polonio.
El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.
El selenio es un metaloide que presenta, al igual que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal, el cual está compuesto por moléculas Se8. El selenio negro vítreo formado por anillos Sen con n muy grande y variable (forma amorfa) y por último el selenio gris cristalino de estructura hexagonal, la cual es la forma más común y análoga a la del azufre plástico. Este alótropo exhibe aspecto metálico, de hecho es un semimetal y es fotoconductor.
El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
Y finalmente el polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
OXÍGENO:
Principalmente, es utilizado en medicina como terapia para las personas que tienen dificultad para respirar debido a alguna enfermedad como enfisema o neumonía. El oxígeno gaseoso es venenoso para las bacterias anaeróbicas que producen gangrena (muerte de tejidos orgánicos), por lo que se emplea para eliminarlos. El envenenamiento por monóxido de carbono se trata también con oxígeno gaseoso.
El oxígeno puro es usado para garantizar la combustión completa de los productos químicos.
Una gran cantidad del oxígeno producido para aplicaciones comerciales se emplea para convertir el mineral de hierro en acero.
Obtención de polímeros de poliéster y los anticongelantes. Los polímeros se usan para fabricar plástico y telas.El oxígeno líquido es usado como comburente para el lanzamiento de cohetes espaciales, generalmente empleando RP-1 como combustible, en una mezcla llamada Kerolox.
*Número atómico: 8
*Peso atómico: 15,9994
*Símbolo atómico: O
*Punto de fusión: -218,79° C
*Punto de ebullición: -182,95°C
AZUFRE:
Es un elemento químico fundamental y un componente principal de los aminoácidos cisteina y metionina y, por lo tanto, indispensable para la síntesis de proteínas presentes en todos los organismos vivos. Por tal razón, muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural.
Este no metal tiene un color amarillento fuerte, amarronado o anaranjado y arde con llama de color azul, desprendiendo dióxido de azufre. Es insoluble en agua pero se disuelve en disulfuro de carbono y benceno. Es multivalente, y son comunes los estados de oxidación -2, +2, +4, +6.
En todos los estados (sólido, líquido y gaseoso): según los químicos presenta formas alotrópicas cuyas relaciones no son completamente conocidas. Las estructuras cristalinas más comunes son el octaedro ortorrómbico (azufre α) y el prisma monoclínico (azufre β), siendo la temperatura de transición de una a otra de 96 °C; en ambos casos el azufre se encuentra formando moléculas de S8 con forma de anillo, y es la diferente disposición de estas moléculas la que provoca las distintas estructuras cristalinas. A temperatura ambiente, la transformación del azufre monoclínico en ortorrómbico, es más estable y muy lenta.
*Número atómico: 16
*Peso atómico: 32,065
*Símbolo atómico: S
*Punto de fusión: 119,6° C
*Punto de ebullición: 444,6° C
SELENIO:
Anteriormente estudiamos las formas alotrópicas del selenio. Estas diferentes formas le permiten al selenio tener múltiples aplicaciones dependiendo del alótropo. Por ejemplo, el selenio gris conduce la electricidad, sin embargo su conductividad varía con la intensidad luminosa, es decir, es buen conductor en la luz que en la oscuridad. Por tal razón, se emplea en dispositivos fotoeléctricos, como las células solares, cámaras de rayos x, fotocopiadoras, medidores de luz, diodos LED de color azul y blanco, entre otros.Por su parte, el selenio rojo o como seleniuro de sodio se emplea para proporcionar un color rojo carmesí al vidrio, barnices y esmaltes. También se puede usar para eliminar las tintas de color verde o amarillo ocasionados por otras impurezas durante el proceso de elaboración de vidrio.
Se trata de un elemento de características únicas, siendo éste uno de los elementos más raros de la tabla periódica. Junto a elementos como el hidrógeno, el nitrógeno y el fósforo, se clasifica como un no metal. Si bien existen diversas formas alotrópicas de selenio, sólo tres de ellas se conocen en profundidad: el selenio amorfo, de color rojo; en forma de polvo, de color negro; y en forma cristalina (la forma maś estable del selenio), de un característico color gris metálico.
*Número atómico: 34
*Masa atómica: 78,96 u
*Símbolo atómico: Se
*Punto de fusión: 220,5° C
*Punto de ebullición: 685° C
TELURIO:
El telurio es un metaloide de un pálido color plateado y blancuzco que en estado puro tiene una increíble brillantez metálica. En la tabla periódica lo podemos encontrar en el grupo número 16, en el período 5, siendo uno de los metaloides más conocidos que existen. Cristalizado, el telurio se puede pulverizar con facilidad, mientras que, si se funde, se puede aplicar como corrosivo para el hierro, el cobre y el acero inoxidable.
Se conocen 30 isótopos de telurio, 8 de ellos sólo en estado natural. Sus compuestos son tóxicos.En la naturaleza, es bastante extraño que el telurio se produzca. Generalmente se produce mediante refinación electrolítica.
*Número atómico: 52
*Masa atómica: 127,6 u
*Símbolo atómico: Te
*Punto de fusión: 450° C
*Punto de ebullición: 988° C
POLONIO:
Los isótopos del polonio son una excelente fuente de radiación alfa pura. Aleado con berilio, es una fuente de neutrones.
Esta sustancia se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos. Está químicamente relacionado con el teluro y el bismuto. El polonio es un metal volátil, reducible al 50% tras 45 horas al aire a una temperatura de 54,8 °C (328 K). Ninguno de los 50 isotopos [numero estimado] de polonio es estable. Es extremadamente tóxico y altamente radiactivo. Se ha encontrado polonio en minerales de uranio, humo de tabaco y como contaminante. Todos los elementos a partir del polonio son significativamente radiactivos.
El polonio es similar a elementos como el telurio (Te) y el bismuto (Bi), aunque presenta varias características que lo hacen muy extravagante. Existen 25 isótopos de polonio conocidos y estos tienen masas atómicas que van de 194 u a 218 u.
*Número atómico: 84
*Masa atómica: 208.9824 u
*Símbolo atómico: Po
*Punto de fusión: 254° C
*Punto de ebullición: 962° C
GRUPO 7
Estos elementos se hallan en estado elemental formando moléculas diatómicas, aunque aún no está comprobado con el ástato), las cuales son químicamente activas y de fórmula X2. Posee la siguiente distribución electrónica: s2p5. Para llenar por completo su último nivel energético se necesita de un electrón más, por lo que poseen disposición a formar un ion mononegativo llamado haluro (X–).
Propiedades físicas:
Son elementos no metálicos.
El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
Los halógenos se presentan en moléculas diatómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.
Los puntos de fusión y ebullición aumentan al descender en el grupo.Estos elementos, a temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.El flúor es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
El cloro es un gas amarillo verdoso de olor irritante y fuerte.El bromo es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.El yodo es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
El ástato es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.
Propiedades químicas:
Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica.Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).
FLÚOR:
El elemento cabecera de grupo posee una gran cantidad de aplicaciones en la industria y cotidianidad. Por ejemplo, es usado para elaborar televisores de pantallas plasma, pantallas planas y sistemas microelectromecánicos.
El flúor es el elemento más electronegativo y reactivo y forma compuestos con prácticamente todo el resto de elementos, incluyendo los gases nobles xenón y radón. Su símbolo es F. Incluso en ausencia de luz y a bajas temperaturas, el flúor reacciona explosivamente con el hidrógeno. El flúor diatómico, F2, en condiciones normales es un gas corrosivo de color amarillo casi blanco, fuertemente oxidante. Bajo un chorro de flúor en estado gaseoso, el vidrio, metales, agua y otras sustancias, se queman en una llama brillante. Siempre se encuentra en la naturaleza combinado y tiene tal afinidad por otros elementos, especialmente silicio, que no se puede guardar en recipientes de vidrio.
En disolución acuosa, el flúor se presenta normalmente en forma de ion fluoruro, F-. Otras formas son fluorocomplejos como el [FeF4]-, o el H2F+.
Los fluoruros son compuestos en los que el ion fluoruro se combina con algún resto cargado positivamente.
*Número atómico: 9
*Peso atómico: 18.9984032
*Símbolo atómico: F
*Punto de fusión: -219,67° C
*Punto de ebullición: -188,12° C
CLORO:
2Br – + Cl2 → Br2 + 2Cl-
Es necesario utilizar un proceso de destilación para separarlo del Cl2.
Otro compuesto de cloro que posee importancia comercial es el cloruro de metilo, el cual es empleado en medicina como anestésico. De igual manera, se usa para fabricar algunos polímeros de silicona y para extraer grasas, aceites y resinas.
El cloroformo, triclorometano o tricloruro de metilo, es un compuesto químico de fórmula química CHCl3 que puede obtenerse por cloración como derivado del metano o del alcohol etílico. Este compuesto se emplea como disolvente habitual en los laboratorios de química y biología, por ejemplo en la extracción de vitaminas y sabores. Entre otras aplicaciones del cloroformo es en la extracción y purificación de la penicilina y otros antibióticos. Además para la purificación de diversos alcaloides.
El tricloroetileno es otro compuesto de cloro de suma importancia, que se usa primordialmente como solvente para eliminar grasa de partes metálicas, sin embargo también es un componente en adhesivos, líquidos decapantes de pintura, para corregir escritura a máquina y quitamanchas.
Es un gas de color amarillento y verdoso que tiene la capacidad de combinarse prácticamente con todos los elementos, pero para nuestro cuerpo resulta considerablemente peligroso. Ello se debe a que es un fuerte irritante respiratorio. Así, en estado gaseoso irrita las membranas mucosas y en líquido puede quemar la piel. Solo unas pocas cantidades pueden olerse y tener contacto con nosotros.
*Número atómico: 17
*Peso atómico: 35,453
*Símbolo atómico: Cl
*Punto de fusión: -101.5° C
*Punto de ebullición: -34,04° C
BROMO:
El bromo es el único elemento no metálico que se encuentra en estado líquido a temperatura ambiente. El líquido es rojo, móvil, denso y volátil; se evapora fácilmente a temperaturas y presiones estándar en un vapor rojo (color parecido al que presenta el dióxido de nitrógeno) que presenta un fuerte y desagradable olor. Este halógeno se parece químicamente al cloro, pero es menos reactivo (aunque más que el yodo). El bromo no es muy soluble en agua y se disuelve mejor en disolventes no polares como el disulfuro de carbono, CS2, o el tetracloruro de carbono, CCl4. Reacciona fácilmente con muchos elementos y tiene un fuerte efecto blanqueante.
El bromo es altamente reactivo y es un fuerte agente oxidante en presencia de agua. Reacciona vigorosamente con aminas, alquenos y fenoles, así como con hidrocarburos aromáticos y alifáticos, cetonas y ácidos carboxílicos (estos son bromados por adición o por sustitución). Con muchos de los metales y otros elementos, el bromo anhidro es menos reactivo que el húmedo; sin embargo, el bromo seco reacciona vigorosamente con aluminio, mercurio, titanio y con los metales alcalinos y alcalinotérreos
*El estado de oxidación +1 es poco estable en disolución acuosa y desproporciona a los estados de oxidación -1 y +5. Por ejemplo, el ión hipobromito, BrO-.
*El estado de oxidación +3 es poco estable en disolución acuosa y desproporciona a los estados de oxidación +1 y +5. Por ejemplo, el ión bromito, BrO2-, o el ácido bromoso, HBrO2.
*El estado de oxidación +5 es termodinámicamente estable frente a la desproporción en disolución acuosa. Por ejemplo, el ión bromato, BrO3-.
*El ión bromato, BrO4-, con un estado de oxidación +7, se reduce con relativa facilidad y se prepara por oxidación a partir de estados de oxidación inferiores.
*El bromo también forma compuestos con otros halógenos (interhalógenos). Por ejemplo, BrF5,
BrF3, IBr, etcétera.
*Hay muchos compuestos en los que el bromo presenta estado de oxidación -1, llamándose a éstos bromuros.
YODO:
Al igual que todos los halógenos, forma un gran número de moléculas con otros elementos, pero es el menos reactivo de los elementos del grupo, y tiene ciertas características metálicas. Puede presentar diversos estados de oxidación: −1, +1, +3, +5, +7. Reacciona con el mercurio y el azufre.
Compuestos
El yodo diatómico (I2) en una disolución de yoduro (I-) forma poliyoduros como el triyoduro, I3-, o el pentayoduro, I5-. También forma compuestos con otros haluros, por ejemplo el IF8-.
En disolución acuosa puede presentar diferentes estados de oxidación. Los más representativos son el -1, con los yoduros, el +5 formando yodatos, y el +7, peryodatos (oxidante fuerte).
El yoduro de hidrógeno (HI), se puede obtener por síntesis directa con yodo molecular e hidrógeno molecular, o bien con yodo molecular y un reductor.
Los yodatos (IO3- pueden obtenerse a partir de yodo molecular con un oxidante fuerte).
Algunos yoduros de metales pueden obtenerse por síntesis directa, por ejemplo:
Fe + I2 → FeI2
Y a partir de éste pueden obtenerse otros por sustitución.
Isótopos
Hay 37 isótopos de yodo, pero solo el I-127 es estable. El radioisótopo artificial yodo-131 (un emisor beta y gamma)3 con un periodo de semidesintegración de 8 días se ha empleado en el tratamiento de cáncer y otras patologías de la glándula tiroidea. El yodo-129 (con un periodo de semidesintegración de unos 16 millones de años) se puede producir a partir del xenón-129 en la atmósfera terrestre, o también a través del decaimiento del uranio-238. Como el uranio-238 se produce durante cierto número de actividades relacionadas con la energía nuclear, su presencia (la relación 129I/I) puede indicar el tipo de actividad desarrollada en un determinado lugar. Por esta razón, el yodo-129 se empleó en los estudios de agua de lluvia en el seguimiento del accidente de Chernóbil. También se ha empleado como trazador en el agua superficial y como indicador de la dispersión de residuos en el medio ambiente. Otras aplicaciones pueden estar impedidas por la producción de yodo-129 en la litosfera a través de un número de mecanismos de decaimiento.
En muchos aspectos el yodo-129 es similar al cloro-36. Es un halógeno soluble, relativamente no reactivo, existe principalmente como anión no solvatado, y se produce por reacciones in situ termonucleares y cosmogénicas. En estudios hidrológicos, las concentraciones de yodo-129 se dan generalmente como la relación de yodo-129 frente al yodo total (prácticamente todo yodo-127). Como en el caso de la relación 36Cl/Cl, las relaciones 129I/I en la naturaleza son bastante pequeñas, 10−14 a 10−10 (el pico termonuclear de 129I/I durante las décadas 1960 y 1970 alcanzó unos valores de 10−7). El yodo-129 se diferencia del cloro-36 en que su periodo de semidesintegración es mayor (16 frente a 0,3 millones de años), es altamente biofílico y se encuentra en múltiples formas iónicas (generalmente I- y yodatos) que tienen distinto comportamiento químico.
*Número atómico: 53
*Masa atómica: 126,90447 u
*Símbolo atómico: I
*Punto de fusión: 83° C
*Punto de ebullición: 184° C
ASTATO:
El ástato tiene 31 isótopos elevadamente inestables, por lo que solo se han podido producir unos pocos microgramos en los laboratorios. Por esta razón, no presenta alguna aplicabilidad comercial, salvo en investigaciones científicas y médicas.
Elemento químico con símbolo At y número atómico 85. El ástato es el elemento más pesado del grupo de los halógenos, ocupa el lugar debajo del yodo en el grupo VII de la tabla periódica. El ástato es un elemento muy inestable, que existe sólo en formas radiactivas de vida corta. Se han preparado unos 25 isótopos mediante reacciones nucleares de transmutación artificial. El isótopo con mayor tiempo de vida es el 210At, el cual decae en un tiempo de vida media de sólo 8.3 h. Es improbable que una forma más estable, o de vida más larga, pueda encontrarse en la naturaleza o prepararse en forma artificial. El isótopo más importante es el 211At y se utiliza en marcaje isotópico. El ástato se encuentra en la naturaleza como parte integrante de los minerales de uranio, pero sólo en cantidades traza de isótopos de vida corta, continuamente abastecidos por el lento decaimiento del uranio. La cantidad total de ástato en la corteza terrestre es menor que 28 g (1 onza).
En solución acuosa, el ástato tiene propiedades similares al yodo excepto por las diferencias atribuibles al hecho de que las soluciones de ástato son, por necesidad, muy diluidas. Al igual que el halógeno yodo, se extrae con benceno cuando se halla como elemento libre en solución. El elemento en solución es reducido por agentes como el dióxido de azufre y es oxidado por bromo. Es el menos electronegativo de todos los halógenos. Tiene estados de oxidación con características de coprecipitación semejantes a las del ion yoduro, yodo libre y del ion yodato. Agentes oxidantes fuertes producen el ion astatato, pero no el ion perastatato. Es más fácil obtenerlo y caracterizarlo en estado libre por su alta volatilidad y facilidad de extracción con disolvente orgánicos.
*Número atómico: 85
*Masa atómica: 208.9824 u
*Símbolo atómico: At
*Punto de fusión: 254° C
*Punto de ebullición: 962° C
CONCLUSIONES
- Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupo.
- Los elementos del grupo IA, a excepción del hidrógeno, son metales con valencia química +1; mientras que los del grupo VIIA, exceptuando el astato, son no metales, que normalmente forman compuestos con valencia -1.
- El grupo VIIA del Sistema Periódico o grupo de los Halógenos se caracteriza por el carácter iónico de muchos de sus compuestos, al reaccionar con metales.
- La posición central del grupo IVA hace que su comportamiento sea un poco especial, sobre todo el de su primer elemento carbono, que, tiene la propiedad de unirse consigo mismo, formando cadenas y dando lugar así a una infinidad de compuestos que constituyen la llamada Química Orgánica.
WEBGRAFIA
- https://es.wikipedia.org/wiki/Grupo_del_Carbono
- http://www.quimicaweb.net/tablaperiodica/paginas/grupoVA.htm
- https://es.wikipedia.org/wiki/Grupo_del_nitr%C3%B3geno
- https://www.lenntech.es/periodica/elementos/n.htm
-https://www.lenntech.es/periodica/elementos/s.htm
-https://www.lenntech.es/periodica/elementos/s.htm
-http://www.quimicaweb.net/tablaperiodica/paginas/grupoVIIA.htm






















FALTÓ JUEGO 1,0
ResponderBorrarFALTARON LOS GRUPO 5,6,7 2,5
DEFINITIVA 2,0
DEFINITIVA NIVELACION 4.5
ResponderBorrar