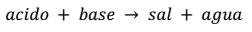Los indicadores de pH son fundamentales para determinar la cantidad de pH que se encuentra en un medio específico. Cuando se habla del concepto de pH, este representa la concentración de iones de hidronio (H3O+) que se encuentra presente en una solución acuosa.
Se tiene como objetivo principal comprender que el PH es el Potencial de Hidrógeno. Es una medida para determinar el grado de alcalinidad o acidez de un disolución estos se pueden dividir en ácidos, neutros, bases. Los ácidos tienen un sabor ácido, corroen el metal, cambian el litmus tornasol (una tinta extraída de los liquenes) a rojo y se vuelven menos acidos cuando se mezclan con las bases. Las bases son resbaladizas, cambian de ltmus a azul y se vuelven menos basicas cuando se mezclan con ácidos.
OBJETIVOS
- Aprender a medir el pH de una solución mediante un indicador
-Identificar si la sustancia vertida es ácida o alcalina mediante la escala de pH
-Asimilar los conceptos de fenolftaleina,tornasol y universal
MARCO TEORICO
¿ QUE ES EL PH?
El pH es una medida de acidez o alcalinidad de una disolución. El pH indica la concentración de iones de hidrógeno presentes en determinadas disoluciones.2 La sigla significa potencial de hidrógeno o potencial de hidrogeniones. El significado exacto de la p en «pH» no está claro, pero, de acuerdo con la Fundación Carlsberg, significa «poder de hidrógeno».3 Otra explicación es que la p representa los términos latinos pondus hydrogenii («cantidad de hidrógeno») o potentia hydrogenii («capacidad de hidrógeno»). También se sugiere que Sørensen usó las letras p y q (letras comúnmente emparejadas en matemáticas) simplemente para etiquetar la solución de prueba (p) y la solución de referencia (q).4 Actualmente en química, la p significa «cologaritmo decimal de» y también se usa en el término pKa, que se usa para las constantes de disociación ácida.5

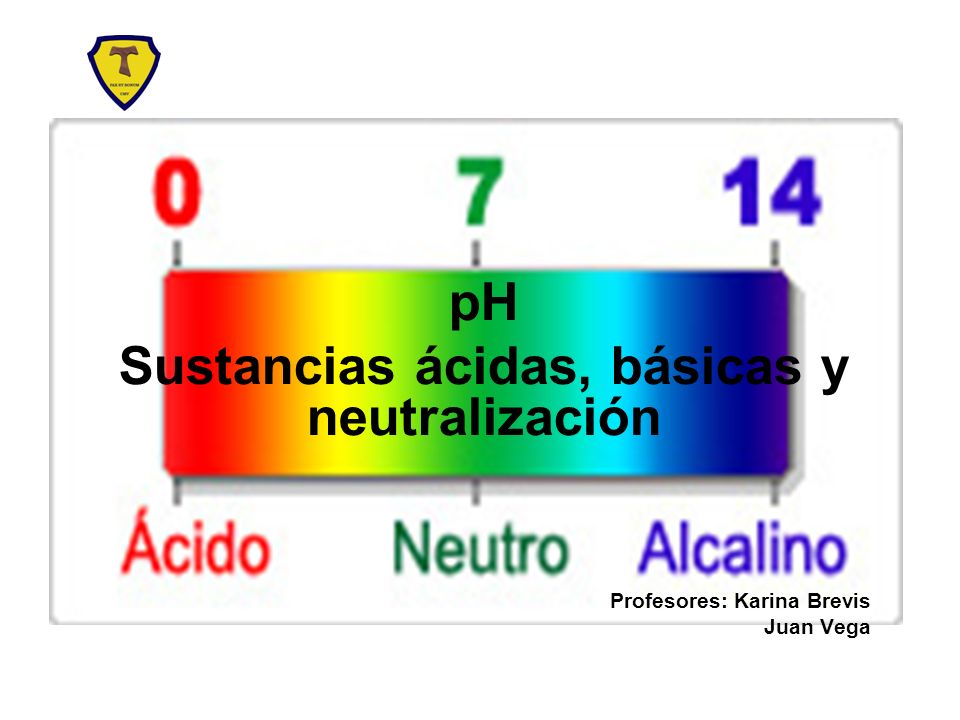
Escala de pH
Los ácidos y bases tienen una característica que permite medirlos: es la concentración de los iones de hidrógeno (H+). Los ácidos fuertes tienen altas concentraciones de iones de hidrógeno y los ácidos débiles tienen concentraciones bajas. El pH, entonces, es un valor numérico que expresa la concentración de iones de hidrógeno .
Hay centenares de ácidos. Ácidos fuertes, como el ácido sulfúrico, que puede disolver los clavos de acero, y ácidos débiles, como el ácido bórico, que es bastante seguro de utilizar como lavado de ojos. Hay también muchas soluciones alcalinas, llamadas "bases", que pueden ser soluciones alcalinas suaves, como la Leche de Magnesia, que calman los trastornos del estómago, y las soluciones alcalinas fuertes, como la soda cáustica o hidróxido de sodio, que puede disolver el cabello humano.
Los valores numéricos verdaderos para estas concentraciones de iones de hidrógeno marcan fracciones muy pequeñas, por ejemplo 1/10.000.000 (proporción de uno en diez millones). Debido a que números como este son incómodos para trabajar, se ideó o estableció una escala única. Los valores leídos en esta escala se llaman las medidas del "pH" .
- La escala pH está dividida en 14 unidades, del 0 (la acidez máxima) a 14 ( nivel básico máximo). El número 7 representa el nivel medio de la escala, y corresponde al punto neutro. Los valores menores que 7 indican que la muestra es ácida. Los valores mayores que 7 indican que la muestra es básica.
-La escala pH tiene una secuencia logarítmica, lo que significa que la diferencia entre una unidad de pH y la siguiente corresponde a un cambio de potencia 10. En otras palabras, una muestra con un valor pH de 5 es diez veces más ácida que una muestra de pH 6. Asimismo, una muestra de pH 4 es cien veces más ácida que la de pH 6.
¿COMO SE MIDE EL PH?
Una manera simple de determinarse si un material es un ácido o una base es utilizar papel de tornasol. El papel de tornasol es una tira de papel tratada que se vuelve color rosa cuando está sumergida en una solución ácida, y azul cuando está sumergida en una solución alcalina.
Los papeles tornasol se venden con una gran variedad de escalas de pH. Para medir el pH, seleccione un papel que dé la indicación en la escala aproximada del pH que vaya a medir. Si no conoce la escala aproximada, tendrá que determinarla por ensayo y error, usando papeles que cubran varias escalas de sensibilidad al pH.
Para medir el pH, sumerja varios segundos en la solución el papel tornasol, que cambiará de color según el pH de la solución. Los papeles tornasol no son adecuados para usarse con todas las soluciones. Las soluciones muy coloreadas o turbias pueden enmascarar el indicador de color.
El método más exacto y comúnmente más usado para medir el pH es usando un medidor de pH (o pHmetro) y un par de electrodos. Un medidor de pH es básicamente un voltímetro muy sensible, los electrodos conectados al mismo generarán una corriente eléctrica cuando se sumergen en soluciones. Un medidor de pH tiene electrodos que producen una corriente eléctrica; ésta varía de acuerdo con la concentración de iones hidrógeno en la solución.
Ejemplos de ácidos:
1.Ácidos de baterías: Se encuentran entre el 0 y el 1, su nivel de ácido es tan fuerte que es perjudicial para las especies.
2.Lluvia ácida: Es un fenómeno que se produce por la acumulación de ácidos provenientes de fósiles y combustibles. En la escala de ácidos se puede ubicar entre el 5 o 2 aproximadamente, siendo el primero el que cause menor daño (por ejemplo, afectar la reproducción de peces). Ya que alcanzar el 2, puede generar la muerte de especies acuáticas. De la misma forma la flora y fauna más delicada.
3.Jugo de limón: Se ubica entre el 2 y el 3.
4.Café: Se ubica en el 5.
Ejemplos de neutro:
1.Sangre
2.Leche
Ejemplos de bases:
1.Leche de magnesia: En la tabla de pH se ubica entre 10 y 11. Este producto es de consumo medicinal.
2.Lejía o cloro: Nivel de alcalinidad 13, se usa para la limpieza del hogar, baños, cocina y tiene el poder de decolorar la ropa.
INDICADORES DE pH
FENOLFTALEINA
La fenolftaleína de fórmula (C20H14O4) es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en presencia de disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,0 (incoloro) a pH=9,8 (magenta o rosado). Sin embargo en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración; en la cual la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna naranja.


La fenolftaleína normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa. El cambio de color no puede explicarse solo basándose en la desprotonación, se produce un cambio estructural con la aparición de una tautomería cetoenólica.
INDICADOR UNIVERSAL
Un indicador universal es colectivamente una mezcla de indicadores que muestran un cambio de color en una solución, que interpreta qué tan ácida o básica es una solución. Un indicador universal puede estar en forma de papel o presente en forma de solución.
-Forma del papel: es una tira de papel de color que cambia de color a rojo si la solución es ácida y a azul si la solución es básica. La tira se puede colocar directamente sobre la superficie de una sustancia húmeda o se pueden dejar caer algunas gotas de la solución sobre el indicador universal utilizando equipo para dejar caer. Si la solución de prueba es de un color oscuro, es preferible utilizar un indicador universal de papel.
-Solución: Los componentes principales de un indicador universal, en forma de solución, son azul de timol , rojo de metilo ,azul de bromotimol y fenolftaleina. Esta mezcla es importante porque cada componente pierde o gana protones dependiendo de la acidez o basicidad de la solución que se está probando. Es beneficioso utilizar este tipo de indicador universal en una solución incolora. Esto aumentará la precisión de la indicación.

INDICADOR TORNASOL
El tornasol es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos acidos, debajo de un índice de pH de 4,5 (de ahí su nombre) y oscurece solo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases. Su uso ha decaído en los últimos años debido a la perfección del indicador universal y de la fenolftaleina.
El tornasol se suministra comúnmente en forma de una solución (llamada titunta) muy concentrada. En raras ocasiones se utiliza puro, en forma de polvo violeta altamente colorante o en tiras indicadoras. Debido a la poca diferencia de color entre el tornasol neutro y el tornasol en contacto con una base, puede encontrarse con un añadido de un 1% de ácido clorhídrico o sulfúrico diluidos. En tal caso, su color es rojo y oscurece inmediatamente a violeta con un líquido básico.

LABORATORIO
Fenoltaleina:
UNIVERSAL:
TORNASOL:
CONCLUSIONES
Un indicador de pH es una sustancia que permite medir el pH de un medio. Habitualmente, se utilizan como indicador a sustancias químicas que cambian su color al cambiar el pH de la disolución.El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie
Se logro identificar los conceptos de fenolftaleina,papel tornasol y papel universal;de que color se van poniendo a medida de que lo ponemos en la escala de pH