INTRODUCCIÓN
En el siguiente blog se realizara una explicación sobre la neutralización, la cual es la reacción que existe entre un ácido y una base, tambien, podemos decir que es la combinación de iones hidronio y de aniones hidróxido para formar moléculas de agua. La neutralización permite establecer la concentracion de una disolución desconocida que pueda actuar como acido neutralizada por medio de una base de concentración conocida. Ademas, es de gran ayuda a la hora de conocer el grado de pureza de ciertas sustancias.
Se mostraran una serie de capturas de pantalla sobre la neutralización, el cual se realizo en la aplicacion Yenka.
OBJETIVOS
-Familiarizarse con los conceptos de neutralización, pH, hidrólisis, soluciones reguladoras y
empleo de indicadores.
- Adquirir destreza en técnicas de titulación ácido-base y en utilizar material volumétrico en general.
- Reconocer que las reacciones que se hacen entre disoluciones ácidas y básicas dan como como producto una sal y agua.
MARCO TEÓRICO
Se llama neutralización a la reacción que se produce entre disoluciones acidas y básicas. Todas estas reacciones dan como producto una sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl). Las reacciones de neutralización son generalmente exotermicas, lo que significa que desprenden energía en forma de calor. Se les suele llamar de neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.

Pueden considerarse tres alternativas adicionales que surgen de la mezcla de un ácido con una base:
-Se mezcla un ácido Fuerte con una base fuerte: Cuando esto sucede, la especie que quedará en disolución será la que esté en mayor cantidad respecto de la otra.
-Se mezcla un ácido débil con una base fuerte:La disolución será básica, ya que será la base la que permanezca en la reacción.
-Se mezcla un ácido débil con una base débil:Si esto sucede, la acidez de una disolución dependerá de la constante de acidez del ácido débil y de las concentraciones tanto de la base como del ácido.
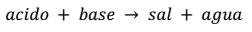












-Se mezcla un ácido Fuerte con una base fuerte: Cuando esto sucede, la especie que quedará en disolución será la que esté en mayor cantidad respecto de la otra.
-Se mezcla un ácido débil con una base fuerte:La disolución será básica, ya que será la base la que permanezca en la reacción.
-Se mezcla un ácido débil con una base débil:Si esto sucede, la acidez de una disolución dependerá de la constante de acidez del ácido débil y de las concentraciones tanto de la base como del ácido.
La ecuación general que representa este tipo de reacción es:
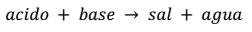
Por ejemplo: HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
Cuando tenemos una disolución con una cantidad de ácido desconocida, dicha cantidad se puede hallar añadiendo poco a poco una base, haciendo que se neutralice la disolución.
Una vez que la disolución ya esté neutralizada, como conocemos la cantidad de base que hemos añadido, se hace fácil determinar la cantidad de ácido que había en la disolución.
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad
Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
Esta expresión se cumple en todas las reacciones de neutralización. Ésta reacción se usa para la determinar la normalidad de una de las disolución, la ácida o la básica, cuando conocemos la disolución con la que la neutralizamos, añadimos así, poco a poco un volumen sabido de la disolución conocida, sobre la solución a estudiar, conteniendo ésta un indicador para poder así observar los cambios de coloración cuando se produzca la neutralización.
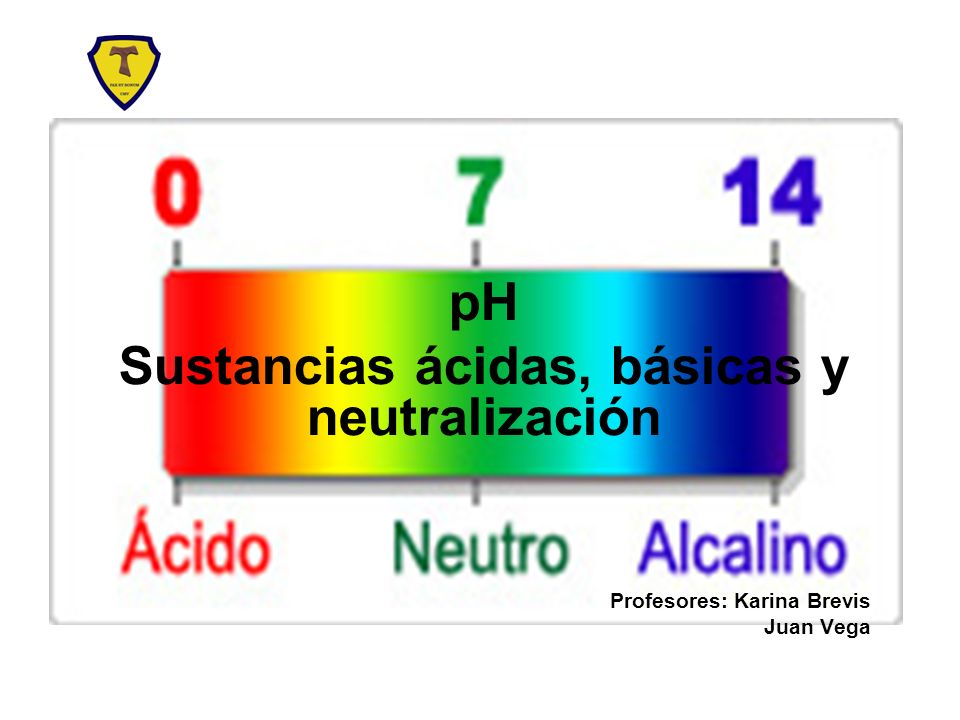
El valor del pH, definido como el – log[H+], cuando los equivalentes del ácido y de la base son iguales, se le conoce como punto de equivalencia. El punto de equivalencia puede ser práctico, o teórico.
En el pH, la escala del 0 al 7, es medio ácido, y del 7 al 14, medio básico, siendo el valor en torno al 7, un pH neutro.
Si valoramos la reacción entre un ácido fuerte y una base fuerte, el punto equivalente teórico estará en torno a 7, produciéndose una total neutralización de la disolución. En cambio, si se estudia un ácido débil con una base fuerte, la sal que se produce se hidrolizará, añadiendo a la disolución iones OH-, por lo tanto el punto de equivalencia será mayor que 7. Y si es el caso de un ácido fuerte con una base débil, la sal que se produce se hidroliza añadiendo los iones hidronios, siendo asñi el punto de equivalencia menos que 7.

LABORATORIO EN YENKA
VASO 1
+ HIDRÓXIDO
FINAL
HNO3 + KOH = H2O + KNO3
VASO 2
+ HIDRÓXIDO
FINAL
HCL + KOH = H2O + KCL
VASO 3
+ HIDRÓXIDO
FINAL
SO4-2 + H2S + KOH = H2O + K2SO4
VASO 4
+ HIDRÓXIDO
FINAL
CONCLUSIÓN
Por el desarrollo de la actividad sobre neutralizacion en el laboratorio virtual de Yenka,aprendimos de forma didáctica el tema de neutralización solo usando 2 tipos de bases y 3 de ácidos.


LE FALTO MAS MARCO TEORICO TITULACION EJERCICIOS DE NEUTRALIZACION 3,3
ResponderBorrar